Einführung in Theorie und Terminologie
Bei der NMR-Spektroskopie (kurz „NMR“) handelt es sich um eine Technik für die Analyse der Struktur von Molekülen (hauptsächlich organische Verbindungen). Eine typische Verbindung könnte aus Kohlenstoff-, Wasserstoff-und Sauerstoffatomen bestehen.
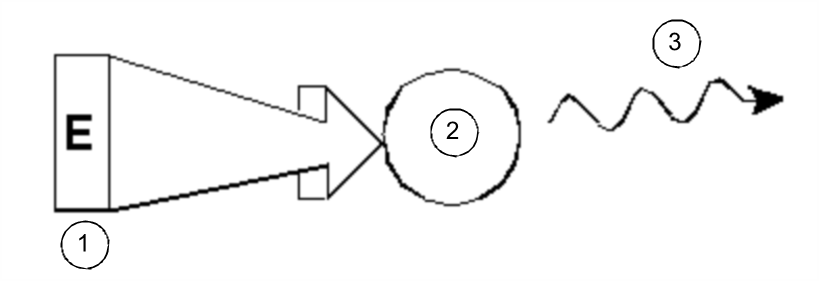
In seiner einfachsten Form umfasst ein NMR-Experiment die folgenden drei Schritte:
- 1.
- Einsetzen der Probe in ein statisches Magnetfeld
- 2.
- Anregen der Kerne in der Probe durch einen Hochfrequenzpuls
- 3.
- Messen der Frequenz der von der Probe ausgesandten Signale
Anregung und Antwort
Aus den ausgesandten Frequenzen kann der Analytiker Informationen über die Bindungen und die Anordnung der Atome in der Probe ableiten. Die NMR-aktiven Kerne in der Probe schwingen bei unterschiedlichen Frequenzen, den so genannten „Resonanzfrequenzen“ mit. Hierbei handelt es sich um die von den Kernen nach Anregung durch einen Hochfrequenzpuls ausgesandten Frequenzen. Der Wert der jeweiligen Resonanzfrequenz hängt von zwei Faktoren ab:
1) Art des Kerns:
Jedes Isotop weist in seinem Kern eine bestimmte Kombination von Protonen und Neutronen auf. Diese Kernstruktur bestimmt im Wesentlichen den Wert der Resonanzfrequenz. Jedes Isotop besitzt somit eine „Basis-Resonanzfrequenz“. 13C-Kerne haben eine andere Basis-Resonanzfrequenz als 1H-Kerne usw. Beachten Sie die in der nachstehenden Tabelle dokumentierte große Bandbreite der Basis-Resonanzfrequenzen verschiedener Isotope:
Datentabelle für verschiedene Isotope (Frequenzangaben für einen 11,7-T-Magneten)
2) Lokale atomare Umgebung:
Der Basis-Resonanzfrequenz überlagert ist ein Effekt, der auf die lokale atomare Umgebung, in der sich das Isotop befindet, zurückzuführen ist. Der präzise Wert der Resonanzfrequenz eines 1H-Kerns in einer bestimmten Verbindung hängt davon ab, an welche Atome der Kern gebunden und von welchen Atomen er umgeben ist. Der Kern ist von Elektronen umhüllt, die als sich bewegende elektrische Ladungen mit zugehörigen Magnetfeldern angesehen werden können. Diese Elektronen bewirken eine magnetische Abschirmung des Kerns. Das Ausmaß dieser Abschirmung hängt von der exakten lokalen atomaren Umgebung ab. Das Ausmaß der typischen Abweichungen des lokalen Felds – die in einer Frequenzabweichung resultieren – hängt von dem jeweiligen Isotop und der Stärke des Magnetfelds, in das die Probe eingebracht wurde, ab. Die nachstehende Tabelle zeigt die typische Frequenzabweichung für zwei der gängigsten NMR-Kerne: 1H und 13C. Natürlich wirkt sich die lokale atomare Umgebung nur in vergleichsweise geringem Ausmaß auf die Basis-Resonanzfrequenz aus.
Frequenzabweichungen (Angaben für einen 11,7-T-Magneten)
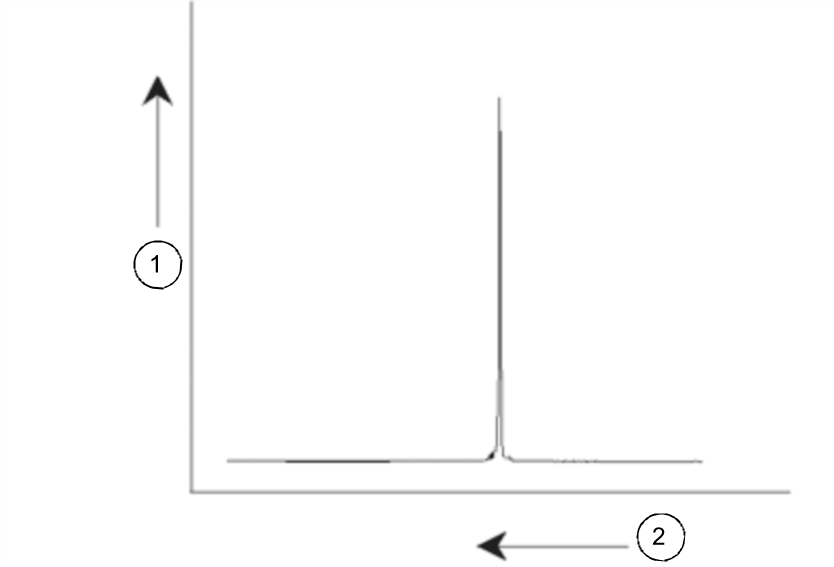
NMR-Signale werden üblicherweise als Spektren dargestellt und in Hinsicht auf die beiden Parameter „Frequenz“ und „Intensität“ analysiert. Konventionsgemäß wird die Frequenz bei NMR-Spektren auf der x-Achse und mit nach links zunehmenden Werten aufgetragen.
NMR-Spektrum
Wie vorstehend bereits erwähnt liefert die Frequenz qualitative Informationen zur lokalen atomaren Umgebung. Das Integral der Intensität eines Signals, d. h. die Fläche unter dem Spektrum, ist ein Maß für die Signalstärke. Das Integral ist direkt proportional zur Anzahl der Kerne, die zu dem Signal bei einer bestimmten Frequenz beitragen (sofern alle Kerne gleichmäßig angeregt werden), und liefert damit quantitative Informationen zur chemischen Struktur.
Um im Rahmen eines NMR-Experiments einen bestimmten Kern anzuregen, sollte die Frequenz des Anregungspulses möglichst nahe bei der Resonanzfrequenz dieses Kerns liegen. Diese Frequenz wird als Trägerfrequenz bezeichnet. Die Durchführung von Experimenten unter Verwendung eines 11,7-T-Magneten erfordert somit für 1H-Kerne eine Trägerfrequenz von etwa 500 MHz, während die Trägerfrequenz für 13C-Kerne möglichst nah bei 126 MHz liegen muss. Die Trägerfrequenz wird durch den Parameter SFO1 festgelegt. Der durch diese Trägerfrequenz angeregte Kern wird als „beobachteter Kern“ bezeichnet.
Beachten Sie bitte, dass bei manchen Experimenten mehr als ein Kern angeregt wird, beispielsweise bei einem Polarisationstransfer oder einer Entkopplung. In Fällen wie diesen liegen mehrere Trägerfrequenzen vor, jedoch nach wie vor nur eine beobachtete Frequenz.
Nicht alle Isotope antworten auf Hochfrequenzpulse, d. h. nicht alle sind NMR-aktiv. Das Element Wasserstoff ist in der Natur durch drei Isotope vertreten: 1H (Wasserstoff), 2H (Deuterium) und 3H (Tritium, radioaktiv!). Der Anteil dieser Isotope an dem in der Natur vorkommenden Wasserstoff liegt bei 99,98 %, 0,015 % bzw. 0,005 %. Alle drei Isotope sind NMR-aktiv, obwohl sie, wie Tabelle 3.1 zu entnehmen ist, große Unterschiede in der Resonanzfrequenz aufweisen. Um eine Probe auf Wasserstoff zu analysieren, wird das Isotop 1H angeregt, da dieses bei weitem am häufigsten auftritt. Von den in der Natur vorkommenden Kohlenstoff-Isotopen ist nur eines NMR-aktiv. Das bei weitem häufigste Isotop, 12 C (natürliches Vorkommen: 98,89 %) ist NMR-inaktiv. Die NMR-Analyse von organischen Verbindungen auf Kohlenstoff basiert somit auf den vom Isotop 13C, dessen natürliches Vorkommen bei 1,11 % liegt, ausgesandten Signalen. Offensichtlich ist die NMR-Analyse auf Kohlenstoff schwieriger als die auf beispielsweise 1H. (Weitere sich auf die Empfindlichkeit auswirkende Faktoren werden in den nächsten Abschnitten dieses Kapitels besprochen).
Nach dieser kurzen Einleitung in die NMR-Analyse soll nun zu Übungszwecken erläutert werden, wie die Technik für die Analyse der Zusammensetzung einer einfachen organischen Verbindung eingesetzt werden kann: Chloroform (CHCl3).
Weiterführende Informationen