Wstępne informacje teoretyczne i terminologia
NMR jest metodą wykorzystywaną do analizy struktury wielu cząsteczek związków chemicznych, w szczególności związków organicznych. Typowy związek może składać się z atomów węgla, wodoru i tlenu.
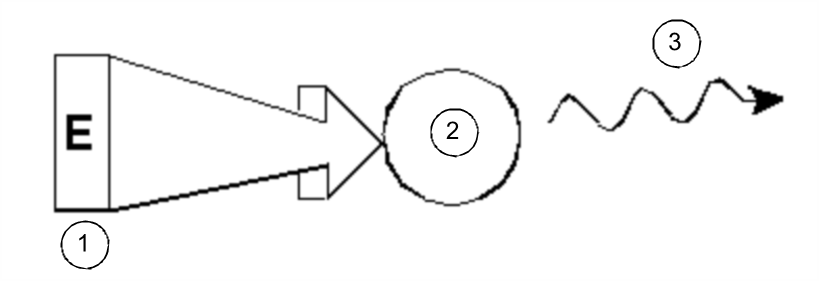
W najprostszej formie eksperyment NMR składa się z trzech etapów:
- 1.
- Umieszczenie próbki w statycznym polu magnetycznym.
- 2.
- Wzbudzenie jąder w próbce za pomocą impulsów o częstotliwości radiowej.
- 3.
- Pomiar częstotliwości sygnałów emitowanych przez próbkę.
Wzbudzenie i odpowiedź
Na podstawie częstotliwości wyemitowanej analityk może uzyskać informacje dotyczące wiązań chemicznych oraz rozmieszczenia atomów w próbce. Znajdujące się w próbce jądra aktywne w spektrometrii NMR rezonują z różną częstotliwością określaną jako „częstotliwość rezonansowa“. Są to częstotliwości emitowane przez jądra po ich wzbudzeniu przez wysyłany impuls o częstotliwości radiowej. Wartość częstotliwości rezonansowej zależy od dwóch czynników:
1) Rodzaj jądra atomowego:
Każdy izotop charakteryzuje się określoną kombinacją protonów i neutronów znajdujących się w jego jądrze. Struktura jądra określa w znacznym stopniu wartość częstotliwości rezonansowej. Oznacza to, że każdy izotop ma pewną podstawową częstotliwość rezonansową. Jądra 13C mają inną podstawową częstotliwość rezonansową od wartości dla jąder 1H itd. Należy pamiętać o dużej zmienności podstawowej częstotliwości rezonansowej w przypadku poszczególnych izotopów wymienionych w poniższej tabeli.
Tabela z danymi dla różnych izotopów (częstotliwości dotyczą magnesu o indukcji 11,7 T)
2) Lokalne otoczenie atomowe:
Na podstawową częstotliwość rezonansową nakłada się efekt wynikający z lokalnego otoczenia atomowego, w którym znajduje się izotop. Dokładna wartość częstotliwości rezonansowej jądra 1H w konkretnym związku chemicznym zależy od atomów, z którym jest ono połączone wiązaniami i które je otaczają. Jądro jest otoczone przez elektrony, które można traktować jako poruszające się ładunki elektryczne z towarzyszącymi im polami magnetycznymi. Elektrony te oddziałują stanowiąc źródło przesłaniania magnetycznego jądra. Wielkość przesłaniania zależy od konkretnego lokalnego otoczenia atomowego. Wielkość typowych zmian pola skutkująca w zmianie częstotliwości, zależna jest od izotopu, a także od natężenia pola magnetycznego, w którym umieszczona jest próbka. W tabeli poniżej przedstawiono typową zmienność częstotliwości dwóch jąder wykorzystywanych najczęściej w NMR, czyli 1H i 13C. Jest niewątpliwe, że lokalne otoczenie atomowe będzie miało stosunkowo niewielki wpływ na podstawową częstotliwość rezonansową.
Zmiany częstotliwości (dotyczą magnesu o indukcji 11,7 T)
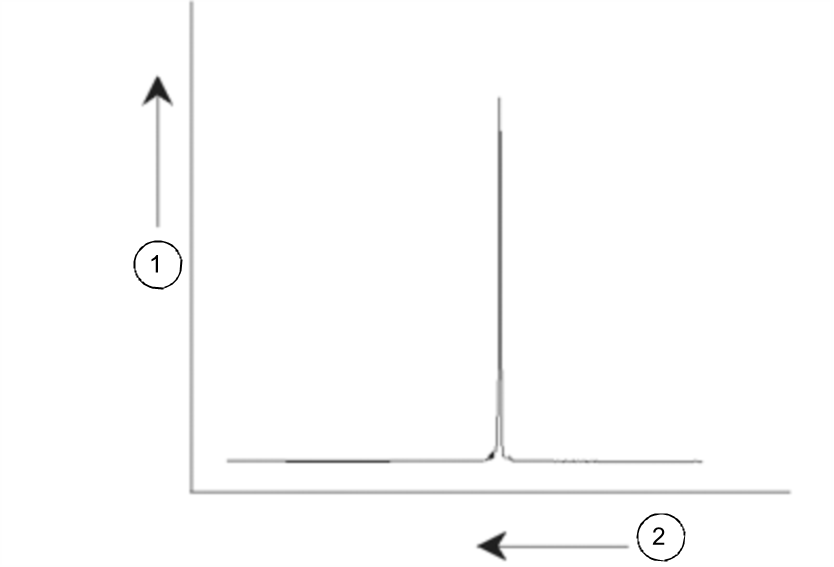
Sygnały NMR wykreśla się zazwyczaj w postaci widm i analizuje w odniesieniu do dwóch właściwości: częstotliwości i natężenia. Według konwencji stosowanej w przypadku rezonansu NMR częstotliwość wykreśla się na osi poziomej, przy czym wzrasta ona w lewo.
Widmo NMR
Jak zaznaczono powyżej, częstotliwość niesie informacje jakościowe dotyczące lokalnego otoczenia atomowego. Natężenie scałkowane sygnału jest miarą natężenia sygnału; wyznacza się je za pomocą całkowania pola powierzchni pod pikiem sygnału.
Całka ta jest wprost proporcjonalna do liczby jąder, które składają się na dany sygnał przy konkretnej częstotliwości (jeśli wszystkie jądra ulegają wzbudzeniu w takim samym stopniu), dlatego daje informacje jakościowe dotyczące struktury związku chemicznego.
Aby nastąpiło wzbudzenie danego jądra w eksperymencie NMR, częstotliwość impulsu wzbudzającego powinna ściśle odpowiadać częstotliwości rezonansowej jądra. Częstotliwość ta nosi nazwę częstotliwości nośnej. Oznacza to, że jeśli eksperymenty prowadzi się za pomocą magnesu o indukcji 11,7 T, jądra 1H wymagają częstotliwości nośnej wynoszącej w przybliżeniu 500 MHz, zaś jądra 13C wymagają częstotliwości nośnej bliskiej 126 MHz. Częstotliwość nośna jest określana przez parametr SFO1. Jądro ulegające wzbudzeniu przez taką częstotliwość nośną nosi nazwę jądra rejestrowanego.
Należy pamiętać, że występują eksperymenty, w których wzbudzeniu ulega więcej niż jedno jądro, np. podczas przeniesienia polaryzacji lub rozprzęgania. W tych przypadkach istnieje więcej niż jedna częstotliwość nośna, jednak nadal tylko jedna częstotliwość rejestracji.
Nie wszystkie izotopyreagują na impulsy o częstotliwości radiowej, tzn. nie wszystkie są aktywne w NMR. W przyrodzie występują trzy izotopy wodoru: 1H (wodór), 2H (deuter) i 3H (tryt, promieniotwórczy!). Naturalna zawartość tych izotopów wynosi odpowiednio 99,98%, 0,015% i 0,005%. Wszystkie trzy jądra są aktywne w NMR, jednak, jak widać na podstawie tabeli 3.1, wszystkie charakteryzują się znaczną zmiennością częstotliwości rezonansowej. Aby przeprowadzić analizę próbki w odniesieniu do wodoru, wzbudzeniu ulega izotop 1H, ponieważ izotop ten występuje w największej ilości. Spośród izotopów węgla występujących w przyrodzie tylko jeden jest aktywny w NMR. Okazuje się, że izotop występujący w największej ilości, 12C (98,89% zawartości w przyrodzie) jest nieaktywny. W związku z tym w analizie związków organicznych metodą NMR wykorzystuje się sygnały emitowane przez izotop 13C, którego zawartość naturalna wynosi zaledwie 1,11%. Analiza NMR w przypadku węgla jest rzecz jasna trudniejsza niż, na przykład, 1H (występują inne czynniki wpływające na czułość, które zostaną omówione w kolejnych punktach tego rozdziału).
Na podstawie tego krótkiego wprowadzenia do metody NMR warto zrobić ćwiczenie i zastanowić się, w jaki sposób można ją wykorzystać do analizy składowych chloroformu (CHCl3).
Dalsze informacje