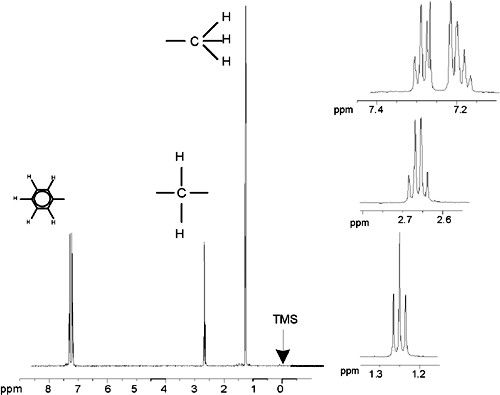
Le spectre proton de l'éthylbenzène avec couplage spinspin
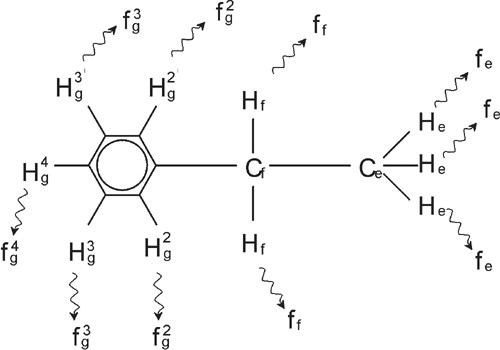
La description du spectre RMN du proton a donc été considérablement simplifiée du fait que tous les signaux, hormis ceux provenant du noyau benzénique, sont des singulets. La structure du composé organique éthylbenzène et le spectre proton correspondant sont respectivement illustrés dans la figure "La molécule d'éthylbenzène" et dans la figure "Spectre proton de l'éthylbenzène". Comme précédemment, les protons ont été classés en trois groupes distincts correspondant aux trois environnements chimiques.
La différence la plus manifeste entre les signaux de ce spectre et ceux de l'acétate de benzyle réside dans la démultiplication des signaux (multiplets). Le signal induit par les protons CH3 est un triplet tandis que le signal induit par les protons CH2 est un quartet. On notera également que les positions des signaux ne coïncident pas : les protons CH3 dans l'acétate de benzyle induisent un signal à 1,85 ppm, tandis que ceux de l'éthylbenzène induisent un signal à 1,25 ppm. Ceci était prévisible puisque les deux groupes de protons CH3 sont situés dans des environnements chimiques différents.
Cette démultiplication provient d'un effet appelé couplage spinspin. Ce sujet dépassant le cadre du présent manuel, il ne sera pas traité ici. Il est donc conseillé au lecteur de se référer à un texte RMN standard pour obtenir de plus amples informations. En ce qui nous concerne, une brève description du couplage spinspin devrait suffire ici.
La molécule d'éthylbenzène
Spectre proton de l'éthylbenzène
La démultiplication des signaux de RMN dans la figure "Spectre de l'éthylbenzène" résulte d'une interaction magnétique entre protons voisins. Du fait de la rotation rapide des atomes autour des liaisons chimiques les deux protons Hf sont magnétiquement équivalents et n'interagissent pas entre eux. De même, les trois protons He sont magnétiquement équivalents et n'interagissent pas entre eux. Cependant, les deux protons Hf et les trois protons He se situent dans des environnements locaux différents et sont « couplés » les uns aux autres par les électrons des liaisons chimiques. Le résultat net de ce couplage se traduit par une interaction mutuelle des deux groupes de protons, donnant lieu à une démultiplication des signaux de RMN.
Les deux protons Hf peuvent exister dans trois états magnétiques différents (résultat des différentes orientations des moments magnétiques). Suite au couplage, les signaux de RMN induits par les protons He correspondent à trois fréquences possibles, d'où l'observation d'un Triplet.
De même, le couplage des protons He produit la démultiplication du signal des protons Hf. Les trois protons He peuvent se combiner pour exister dans quatre états magnétiques différents. Par conséquent, les signaux induits par les protons Hf correspondent à quatre fréquences possibles, le signal est donc démultiplié en quadruplet.
Les signaux induits par les protons de benzène ont également été démultipliés du fait de la nonéquivalence chimique et du couplage spinspin. Pourquoi les protons CH2 et CH3 d'éthylbenzène interagissentils entre eux alors que les deux groupes de protons comparables d'acétate de benzyle ne le font pas ? La réponse se trouve dans le nombre de liaisons séparant les deux groupes. Dans l'éthylbenzène, les deux groupes de protons sont reliés aux atomes de carbone adjacents et l'on peut s'attendre à ce qu'ils interagissent suffisamment entre eux. Dans l'acétate de benzyle en revanche, les deux atomes de carbone Cc et Cb sont reliés via deux liaisons supplémentaires entre un atome d'oxygène et un autre atome de carbone. Par conséquent, les groupes de protons sont trop éloignés les uns des autres pour présenter un couplage spinspin significatif.